

Lösung von Kohlendioxid im Wasser
Lösung von CO
2
im Wasser
Die Lösung von gasförmigem CO 2 im Wasser ist ein physikalischer Prozess. Es handelt sich dabei um einen Gasaustausch zwischen der Luft und dem Wasser. CO 2 aus der Luft tritt in das Wasser über und gleichzeitig gehen aber auch CO 2 -Moleküle aus dem Wasser in die Luft über.
Abbildung: Verteilung von CO
2
zwischen Luft und Wasser
bei 0,040 Vol.-% in der Atmosphäre

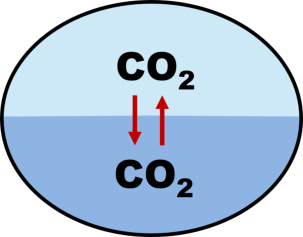
Zwischen
beiden
Prozessen
stellt
sich
ein
Gleichgewicht
ein,
wenn
pro
Zeiteinheit
genauso
viele
CO
2
-Moleküle
aus
der
Luft
in
das
Wasser
wandern
wie
in
der
Gegenrichtung
aus
dem
Wasser
in
die
Luft.
In
der
Luft
und
im
Wasser
stellen
sich
so
die
entsprechenden
Gleichgewichtskonzentrationen
ein,
die
den
vorhandenen
physikalischen Bedingungen (z.B. Temperatur, Druck) entsprechen.
Die
Löslichkeit
kann
durch
den
Verteilungskoeffizienten
K
oder
den
Bunsen‘schen
Absorptionskoeffizienten
α
beschreiben werden.
Die
Löslichkeit
im
Wasser
ist
abhängig
von
der
Temperatur
und
vom
Partialdruck
des
CO
2
in der Luft.
Der
Bunsen‘sche
Absorptionskoeffizient
α
beträgt
für
CO
2
etwa
1,2.
Das
heißt,
dass
sich
im
Gleichgewicht
mit
der
Luft
im
Wasser
etwa
die
1,2-fache
Konzentration
einstellt.
Dies
bedeutet
wiederum,
dass
sich
CO
2
sehr
gut
im
Wasser
löst
(Zum
Vergleich O
2
:
α
=0,38).
Abbildung: Gasaustausch von CO
2
zwischen Luft und Wasser

Kohlendioxid







