
Calcit-Sättigung eines Wassers
Calcit-Sättigung = Kalk-Kohlensäure-Gleichgewicht
Kalk-Kohlensäure-Gleichgewicht
Wenn in einem Wasser das Kalk-Kohlensäure-Gleichgewicht herrscht, dann sind alle beteiligten Reaktionen im Reaktionsgleichgewicht. Ausführliche Schemata hierzu im Fachbuch Kohlendioxid. Es wird weder Kalk gelöst noch fällt Kalk aus.Lösung und Fällung von Kalk
Calcit löst sich physikalisch im Wasser bis zur Löslichkeitsgrenze, die durch das Löslichkeitsprodukt L charakterisiert wird. Das Löslichkeitsprodukt wird über die Akivitäten der Stoffe a() definiert.
Ist
a(Ca
2+
)∙a(CO
3
2-
) > L
dann ist das Wasser kalkabscheidend
Ist
a(Ca
2+
)∙a(CO
3
2-
) = L
dann ist das Wasser im Gleichgewicht
(Calcitsättigung)
Ist
a(Ca
2+
)∙a(CO
3
2-
) < L
dann ist das Wasser kalklösend
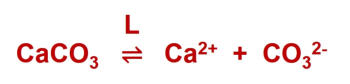
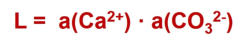
Das Löslichkeitsprodukt für Calcit beträgt bei 10°C : L = 3,92∙10
-9
(mol/L)
2
Calcit ist schwer löslich.
Die
rein
physikalische
Lösung
von
Calcit
im
Wasser
führt
immer
nur
zur
Calcit-
Sättigung. Das Löslichkeitsprodukt kann so nicht überschritten werden.
Es
kommt
immer
dann
zu
einer
Calcitfällung,
wenn
das
Löslichkeitsprodukt
von
Calcit
überschritten wird, zum Beispiel:
>
Ein
mit
Calcit
gesättigtes
Wasser
wird
erwärmt.
Die
Löslichkeit
(L)
von
Calcit
nimmt
mit
steigender
Temperatur
ab,
so
dass
dann
die
Löslichkeit
überschritten
wird. (z.B. Kesselstein-Bildung)
>
Aus
einem
Calcit
gesättigten
Wasser
entweicht
CO
2
an
die
Luft.
Dadurch
steigt
der
pH-Wert
des
Wassers,
so
dass
sich
der
Anteil
des
Carbonats
im
Wasser
erhöht.
Das Löslichkeitsprodukt wird dadurch überschritten und Kalk kann ausfallen.
(z.B. Bildung von Quellkalken)
>
In
einem
Calcit
gesättigten
Wasser
steigt
der
pH-Wert
des
Wassers
durch
andere
Prozesse,
z.B.
Photosynthese,
so
dass
sich
der
Anteil
des
Carbonats
im
Wasser
erhöht.
Das
Löslichkeitsprodukt
wird
dadurch
überschritten
und
Kalk
kann
ausfallen. (z.B. Bildung von Seekreide)
Alle drei Prozesse können sich gegenseitig verstärken.
Charakterisierungsgrößen für das Verhalten der Kohlensäure gegenüber Kalk
sind:
- Delta-pH-Wert ΔpH Der Delta-pH-Wert ist die Differenz zwischen dem aktuellen pH-Wert des Wassers und dem pH-Wert der Calcitsättigung, eingestellt mit Calcit. Der Delta-pH-Wert kann gemessen werden. ΔpH < 0 (-) das Wasser ist kalklösend ΔpH > 0 (+) das Wasser ist kalkabscheidend ΔpH = 0 das Wasserst ist im Gleichgewicht (Calcitsättigung) - pH-Wert der Calcitsättigung pH C Der pH-Wert der Calcitsättigung ist der pH-Wert des Wassers bei Calcitsättigung (Kalk-Kohlensäure-Gleichgewicht), eingestellt mit Calcit. - Sättigungsindex SI Der Sätigungsindex ist eine reine Rechengröße (kann nicht durch eine Messung ermittelt werden). Er gibt wie der Delta-pH-Wert die Abweichung von der Calcitsättigung an. Die Vorzeichen sind analog zum Delta-pH-Wert, die Zahlenwerte weichen ab. - Kalklösevermögen D(+) Das Kalklösevermögen gibt bei einem kalklösenden Wasser an, wieviel Kalk gelöst werden kann. Das Vorzeichen bei kalklösendem Wasser ist (+), im Gegensatz zum Delta-pH-Wert und Sättigungsindex. - Kalkabscheidekapazität D(-) Die Kalkabscheidekapazität gibt bei einem kalkabscheidenden Wasser an, wieviel Kalk abgeschieden werden kann. Das Vorzeichen bei kalkabscheidendem Wasser ist (-), im Gegensatz zum Delta-pH-Wert und Sättigungsindex.Ursachen für Kalkfällung im Wasserkreislauf
Wenn im Wasser das Löslichkeitsprodukt von Kalk (Calcit) überschritten wird, kommt
es zur Calcitfällung (Kalkfällung).
Dies kann in der Natur hervorgerufen werden durch - Entweichen von CO 2 an die Luft - Photosynthese (CO 2 -Entzug) - Temperaturanstieg: Die Löslichkeit von Kalk nimmt mit steigender Temperatur ab! - Anstieg des pH-Wertes
Kohlensäure





