Der pH-Wert eines Wassers kann bestimmt werden durch
- pH-Indikatoren
- pH-Papier /-Sticks
- pH-Elektrode
pH-Indikatoren / pH-Papier
pH-Indikatoren sind organische Farbstoffe, die durch Aufnahme oder Abgabe von Protonen (H + -Ionen) ihre Farbe ändern (schwache Säuren oder Basen). Für pH- Indikatoren wird ein pH-Bereich für die Farbänderung angegeben. Beispiele: Indikator Umschlagsbereich (pH) Farbänderung Methylorange 3,1 – 4,4 rot - gelborange Phenolphthalein 8,2 – 9,8 farblos - rot Bromkresolpurpur 5,2 – 6,8 gelb - purpur pH-Indikatoren werden tropfenweise in das Wasser gegeben und zeigen dann durch ihre Farbe den pH-Bereich an. Diese Indikatoren werden häufig bei Titrationen zur Bestimmung des Endpunktes der Titration verwendet (z.B. Säurekapazität (Methylorange), Basekapazität (Phenophthalein)). Bromkresolpurpur wird in der Bakteriologie bei der Flüssigkeitsanreicherung von E. coli zum Nachweis der pH- Änderung genutzt. Kornblumen und Mohn haben einen Farbstoff, dessen Ausprägung vom pH-Wert abhängig ist. Zerreibt man eine Mohnblüte und gibt etwas Lauge hinzu, so färbt sich die Lösung blau. Zerreibt man eine Kornblume und gibt etwas Säure hinzu, so färbt sich die Lösung rot. Es sind also natürliche pH-Indikatoren! pH-Papier ist mit pH-Indikatoren getränkt, so dass es durch dies zur Farbänderung kommt. Für genaue Umschlagpunkte verwendet man Mischungen verschiedener Indikatoren (Mischindikatoren). Die pH-Bestimmung mit Indikatoren ist durch den Umschlagsbereich nicht sehr genau. Zudem handelt es sich bei den Indikatoren selbst um schwache Säuren oder Basen, die von sich aus den pH-Wert des Wassers beeinflussen können. Deshalb sind auch pH- Bestimmungen mit pH-Papier oder pH-Sticks in weichen (gering gepufferten) Wässern nicht genau und daher nicht sinnvoll.Messung des pH-Wertes mit der pH-Elektrode
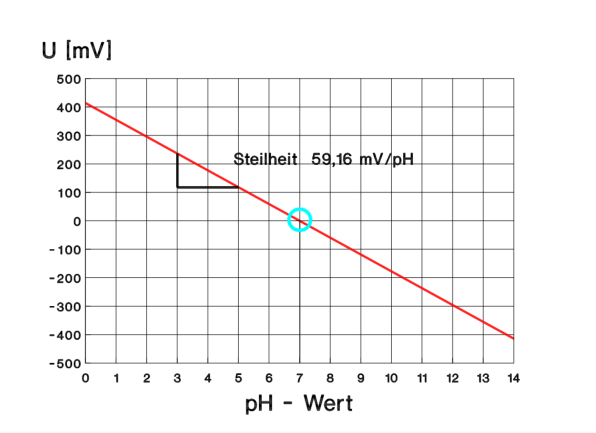
Der pH-Wert wird mit einer pH-Einstabmesskette (Glaselektrode + Bezugselektrode) gemessen. An der Glasmembran baut sich eine pH-abhängige Potentialdifferenz auf, die gegen die Bezugselektrode gemessen wird. Ein Temperaturfühler ist entweder separat vorhanden oder integriert. Der Zusammenhang zwischen dem pH-Wert der Messlösung und der Spannung U der pH-Messkette lässt sich in einem U/pH-Diagramm darstellen. Die Steigung (Steiheit) der idealen Kennlinie bei 25 °C beträgt 59,16 mV/pH (Nernstscher Faktor) : Nullpunkt : U = 0 bei pH = 7 Bild: Ideale Kennlinie einer pH-Messkette bei 25 °C Jede reale pH-Messkette besitzt bei einer konstanten Temperatur eine individuelle pH- Spannungs-Kennlinie. Bei einem gegebenen pH-Wert gibt die Messkette ein bestimmtes Spannungssignal an das Messgerät ab. Diese Kennlinie hat die Form einer Geraden und lässt sich durch die folgende Gleichung beschreiben : U = S · (pH - 7) + UASY U , S , UASY = f(T) S = Steilheit UASY = Asymmetriespannung (Nullpunkt) S und UASY bezeichnen die Abweichung vom Idealzustand und sind individuelle Konstanten einer jeden pH-Messkette. Diese Werte verändern sich durch Lagerung und Gebrauch. Bei neuen Elektroden sollte die Steilheit mindestens 98 % der theoretischen Steilheit betragen. Vor jedem Gebrauch der pH-Elektrode müssen diese Abweichungen von der Ideallinie kompensiert werden, die pH-Elektrode muss mit definierten Pufferlösungen kalibriert werden. Kalibrierung : In den Bedienungsanleitungen für die unterschiedlichen pH-Messgeräte wird auf spezielle Kalibrier-Vorschriften eingegangen. Zum Teil werden nur noch Einpunkt- Kalibrierungen vorgenommen. Vom Prinzip her ist für jede pH-Elektrode bei der Kalibrierung immer zunächst UASY (Asymmetrieregler) anzugleichen (Nullpunkt) und anschließend die Steilheit der Elektrode für den vorgesehenen Arbeitsbereich - entweder basisch oder sauer - einzustellen. Die pH-Werte der Kalibrier-Pufferlösungen sind natürlich ebenfalls temperaturabhängig und gelten streng genommen nur für die angebene Temperatur, in der Regel 20 oder 25 °C ! Prinzipiell geht man wie folgt vor: - Wässerungskappe von der Elektrode abziehen - Elektrode und Temperaturfühler am Gerät anschließen (bzw. Anschluss überprüfen) - Asymmetrieeinstellung: - Elektrode und Temperaturfühler mit deion. Wasser spülen - mit Zellstoffpapier vorsichtig Wassertropfen abtupfen - beide in Pufferlösung pH 7 eintauchen - stabile Anzeige abwarten und den Soll-pH ( 7 ) einstellen - Steilheitseinstellung - Elektrode und Temperaturfühler erneut mit deion. Wasser spülen - mit Zellstoffpapier vorsichtig Wassertropfen abtupfen - beide in die Pufferlösung des Zielbereiches (z.B. entweder z.B. 4 oder 9) eintauchen - stabile Anzeige abwarten und dann den Soll-pH einstellen Die automatische Temperaturkompensation moderner pH-Messgeräte gleicht nur die gerätespezifischen Temperaturabhängigkeiten (S, UASY, usw.) annähernd aus, nicht jedoch die Temperaturabhängigkeit des pH-Wertes aufgrund der Temperatureinflüsse auf die Dissoziationsgleichgewichte des Wassers und der Wasserinhaltsstoffe. Messung Probenentnahme - möglichst wenig Luftkontakt - vor allem bei weichen Wässern - möglichst unmittelbar messen (Temperatur ! , eventuell im Durchfluss) - sonst kühl transportieren (Ausgasungen !) Zur Durchführung der Messung : - pH-Elektrode und Temperaturfühler spülen - am besten mit Probenwasser, dann ist kein Abtupfen notwendig - sonst mit deion. Wasser und wiederum leicht abtupfen - beide in die Messlösung eintauchen und stabile pH-Anzeige abwarten Ist kein Temperaturfühler angeschlossen/integriert, so ist die entsprechende Messtemperatur zur Kompensation direkt am Gerät einzustellen. Angabe der Messergebnisse: - Für Absolutmessungen nach DIN : mindestens eine Stelle nach dem Komma (Maximale Messgenauigkeit absolut: ± 0,05) - Die Messtemperatur ist ebenfalls anzugeben. Für Relativmessungen ist auch die Angabe von zwei Dezimalstellen sinnvoll. Beispiel: pH-Wert 7,46 Messtemperatur ϑ = 12,3 °CAnwendung und Bedeutung des pH-Wertes
- Grenzwert für Trinkwasser nach TVO : 6,5 ≤ pH ≤ 9,5 - Optima für Wasseraufbereitungsverfahren (z.B. Flockung, Enteisenung, Entmanganung) - pH-Bereiche für biologische Umsetzungen (z.B. Nitrifikation, Denitrifikation) - Nitrifikation Optimum pH 6 – 8 unter 6 geht sie sehr stark zurück - Denitrifikation Denitrifikanten Lebensbereich pH 6,2 -10,2 Optimum pH 7 - 8 - pH-Wert der Kalk-Sättigung, ΔpH-Wert - Korrosionschemische Beurteilung von WässernpH-Wert - Messung
(Definition pH-Wert unter Wasserchemie/pH-Wert)


Wasser-Analytik





