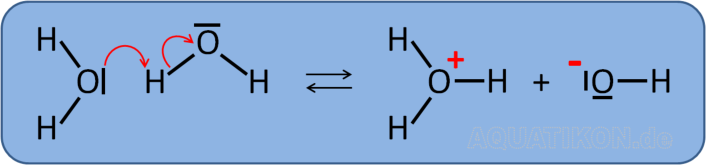
Autoprotolyse des Wassers (Ionenprodukt)
Wasser dissoziiert (Protolyse) zu einem geringen Anteil in H
+
- und OH
-
-Ionen, die
hydratisiert (i)
(aq)
vorliegen :
H
2
O
⇋
H
+
(aq)
+ OH
-
(aq)
Wasserstoff-Ionen H
+
und OH
-
-Ionen liegen in wässriger Lösung nicht frei sondern ein-
oder mehrfach hydratisiert vor.
z.B. H
+
(aq)
: H
3
O
+
, H
5
O
2
+
, H
7
O
3
+
, .........
Bild: Autoprotolyse des Wassermoleküls
Das heißt, die Reaktionsgleichung müsste eigentlich lauten:
H
2
O + H
2
O
⇋
H
3
O
+
+ OH
-
Aus Gründen der Vereinfachung schreibt man jedoch häufig:
H
2
O
⇋
H
+
+ OH
-
Das Massenwirkungsgesetz lautet dann für diese Reaktion:
a(H
+
) · a(OH
-
)
───────── = K
a(H
2
O)
Da durch den geringen Umfang der Dissoziation (sehr kleiner Wert für die Konstante
K) die Aktivität des Wassers a(H
2
O) als konstant angesehen werden kann, wird sie in die
Konstante mit einbezogen und eine neue Konstante K
W
gebildet.
a(H
2
O) = 55,41 mol/L
a(H
+
) = 10
-7
mol/L
→
a(H
2
O) ≈ konstant
→→
a(H
+
) · a(OH
-
) = K · a(H
2
O) = K
w
Die Gleichung lautet dann:
a(H
+
)
·
a(OH
-
) = K
w
[(mol/L)
2
] (Ionenprodukt des Wassers)
Man bezeichnet das Produkt aus a(H
+
)
und
a(OH
-
) als das Ionenprodukt des Wassers.
Der Wert für das Ionenprodukt des Wassers ist von der Temperatur abhängig.
Für die Temperaturabhängigkeit von K
w
gilt (DIN 38404 Teil 10) :
lg K
w
= -13,996 + 2954 · (1/T
0
- 1/T) -10,4 · (ln(T/T
0
) + T
0
/T - 1)
T = Temperatur in K
T
0
= Bezugstemperatur 298,15 K (25 °C)
Bei 25 °C gilt :
T = T
0
= 298,15 K
lg K
w
= -13,996 + 2954 · (0) -10,4 · (0) = - 13,996
→
K
w
= 10
-14
(mol/l)
2
In reinem Wasser entstehen durch die Dissoziation immer 50% H
+
-Ionen und 50% OH
-
-
Ionen.
H
2
O
⇋
H
+
+ OH
-
50% 50%
→ a(H
+
) = a(OH
-
) →
[a(H
+
)]
2
= K
w
= 10
-14
(mol/l)
2
a(H
+
) = K
w
-2
a(OH
-
) = K
w
-2
K
w
-2
= (10
-14
)
-2
= 10
-7
Es liegen dann also
10
-7
mol/L H
+
-Ionen
10
-7
mol/L OH
-
-Ionen im Wasser vor (25 °C !).
Dieses Wasser mit gleichen Aktivitäten an H
+
- und OH
-
-Ionen wird als neutral
bezeichnet.
Liegen mehr -Ionen als H
+
-Ionen vor, so wird es als sauer, liegen mehr OH
-
-Ionen vor,
so wird es als alkalisch bezeichnet.
Ionenprodukt des Wassers